Генное глушение при БГ: история на данный момент
Так ли генное глушение многообещающе для БГ, как кажется, и что может ждать в будущем?

Внимание: Автоматический перевод — возможность ошибок
Чтобы как можно быстрее распространить новости об исследованиях и испытаниях HD среди как можно большего числа людей, эта статья была автоматически переведена искусственным интеллектом и еще не была проверена редактором-человеком. Хотя мы стараемся предоставлять точную и доступную информацию, переводы ИИ могут содержать грамматические ошибки, неправильные толкования или неясные формулировки.Для получения наиболее достоверной информации, пожалуйста, обратитесь к оригинальной английской версии или вернитесь позже, чтобы получить полностью отредактированный человеком перевод. Если Вы заметили существенные проблемы или если Вы являетесь носителем этого языка и хотели бы помочь в улучшении точности перевода, пожалуйста, обращайтесь по адресу editors@hdbuzz.net.
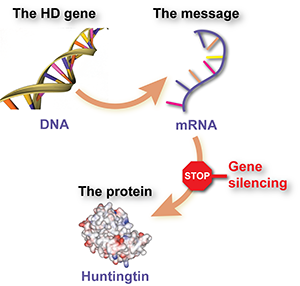
Генное глушение означает использование специально разработанных молекул для «выключения» сообщения, которое заставляет клетки производить вредный белок хантингтин. Наш праймер HDBuzz по генному глушению объясняет методы, результаты на данный момент и предстоящие задачи.
Мы получили много запросов от читателей на написание статьи о «генном глушении», также известном как «глушение хантингтина». Это область исследований, которая вызывает большой интерес. Внимание многих людей к этой теме привлек недавний совместный пресс-релиз Lundbeck и Массачусетского университета, объявляющий об исследовательском сотрудничестве, направленном на разработку методов лечения БГ на основе «РНК-интерференции (RNAi)».
Итак, что такое генное глушение? Как это работает и какую пользу это может принести пациентам с БГ?

Гены, сообщения и белки
Белки — это молекулы, которые действуют как крошечные машины, выполняя большую часть полезной работы внутри клеток — например, обеспечивая химические реакции, передавая сообщения, придавая клеткам структуру и так далее. Каждый отдельный белок создается с использованием набора инструкций, называемого геном. Гены состоят из ДНК и находятся в центре управления клеткой — ядре.
Однако гены не используются для непосредственного создания белков. Вместо этого клетка использует последовательность ДНК гена в качестве шаблона для создания «молекулы-сообщения», называемой «мессенджер РНК» или мРНК. Затем молекула-сообщение мРНК используется для того, чтобы сообщить клетке, какие строительные блоки нужно соединить вместе для создания белка.
Повторим: ДНК используется в качестве шаблона для создания сообщения мРНК, а молекула-сообщение затем используется для построения белковых молекул.
Болезнь Хантингтона вызвана одним аномальным геном — геном, который сообщает клеткам о необходимости производства белка под названием хантингтин. Каждая клетка имеет две копии каждого гена. У большинства людей с БГ или тех, у кого она разовьется позже, есть один «нормальный» ген и один с избыточным количеством повторов трехбуквенной последовательности «CAG» в начале. Эта простая «орфографическая ошибка» приводит к появлению «мутантного» белка, который ведет себя иначе, чем нормальный белок, повреждая клетки и вызывая симптомы БГ.
Возможно, вы слышали термин «дикий тип» — так ученые называют немутантный, или «нормальный», ген и белок.
Глушение гена хантингтина
Поскольку аномальный ген является причиной всех проблем при БГ, почему бы просто не избавиться от него и не заменить его здоровым геном? К сожалению, это вряд ли сработает, потому что у клеток есть очень надежные способы защиты ДНК для предотвращения повреждений или изменений.
С другой стороны, молекула-сообщение мРНК плавает в клетке, и пока она там находится, она будет продолжать использоваться для создания новых белковых молекул. Если бы мы могли каким-то образом сказать клетке игнорировать это сообщение, вредный белок не производился бы. В этом заключается идея «генного глушения». Идея состоит в том, что ученые могут создать лекарство, которое на самом деле является специально разработанной молекулой-сообщением, которая прикрепляется к сообщению хантингтина и говорит клетке избавиться от него.
Генное глушение звучит слишком хорошо, чтобы быть правдой, но это не так. В 1998 году два исследователя, которые впоследствии получили Нобелевскую премию по медицине, разработали способ выключения отдельных генов. Они назвали свою методику РНК-интерференцией (RNAi).
В настоящее время генное глушение является стандартным методом, используемым учеными для изучения того, как работают организмы, как болезни вызывают повреждения, а также как способ разработки методов лечения. Один препарат для генного глушения (Витравен, используемый для лечения вирусной глазной инфекции) лицензирован для использования человеком, и более десятка испытаний продолжаются при различных заболеваниях, и их число растет.
Если бы все было так просто, у нас уже были бы таблетки для генного глушения при болезни Хантингтона, так в чем же подвох? Что ж, как и в случае с любой новой методикой, неизбежно возникнут проблемы, неудачи и неожиданные препятствия на этом пути.
Задача первая: проникновение в мозг
Одной из основных проблем является доставка глушащих молекул туда, где они необходимы. При БГ основной проблемой является гибель клеток мозга, называемых нейронами, поэтому нам необходимо доставить молекулу в эти клетки.
«Несколько различных групп исследователей сообщили об успехе в снижении выработки хантингтина на животных моделях»
Первым препятствием является доставка лекарства в мозг. Мозг имеет естественный защитный барьер, предотвращающий попадание вредных веществ из крови. В целом это хорошо для нас, потому что защищает мозг, но это головная боль для исследователей лекарств от БГ, потому что намного сложнее доставить лекарства в мозг, чем, скажем, в печень или почки.
Поэтому маловероятно, что простая таблетка или инъекция подойдет для борьбы с БГ с помощью генного глушения. Один из способов обойти эту проблему — использовать насосы и крошечные трубки для введения глушащего препарата непосредственно в мозг или в окружающую его жидкость — спинномозговую жидкость или СМЖ. Это звучит довольно пугающе, и нет сомнений в том, что имплантация насосов или трубок в нервную систему — это серьезное дело, но на самом деле аналогичные системы уже используются для доставки лекарств при других заболеваниях, таких как рассеянный склероз (РС) и рак мозга, где они имеют очень хорошие показатели безопасности.
Задача вторая: распространение
После того как лекарство попало в нервную систему, проблема распространения все еще не решена. Мозг — это плотный шар ткани, через который глушащим молекулам трудно распространяться. Более того, для работы лечение должно попасть внутрь клеток — плавать между клетками недостаточно.
Ученые используют различные методы для решения этой проблемы. Лауреаты Нобелевской премии использовали молекулы РНК-интерференции (RNAi) для выключения генов. Они очень похожи на молекулы, вырабатываемые клетками естественным путем. Недостатком является то, что они, как правило, не распространяются естественным путем по мозгу и не очень хорошо проникают в клетки.
Таким образом, исследователи RNAi, как правило, используют очень тонкие трубки, вставленные в вещество мозга, нацеленные на наиболее пораженные области, подключенные к насосам, которые используют давление для дальнейшего распространения лекарства. Другой вариант — позволить молекулам RNAi «подсесть» внутрь деактивированных вирусов, которые являются экспертами в распространении по мозгу и введении веществ в клетки.
Другой подход — попробовать другие молекулы, которые могут лучше распространяться и проникать в клетки. Антисмысловые олигонуклеотиды (ASOs) похожи на молекулы RNAi, но немного проще и не вырабатываются клетками естественным путем. Принцип тот же — они прикрепляются к молекуле-сообщению мРНК и не позволяют клетке использовать ее для построения белков.
ASO, по-видимому, гораздо лучше распространяются по мозгу и могут довольно легко проникать в клетки. Они также, по-видимому, действуют гораздо дольше — что может быть как хорошо, так и плохо, в зависимости от того, насколько хорошо они выполняют свою работу.
Какой метод генного глушения лучше? Мы просто не знаем, поэтому работа над RNAi и ASO ведется одновременно, чтобы выяснить, какой из них лучше.
Задача третья: выключение гена
Ключевым тестом лечения генным глушением является то, может ли оно успешно выключить ген. До сих пор исследования на животных моделях БГ убедительно показали, что этого можно достичь как с помощью методов лечения RNAi, так и ASO.
В 2005 году группа исследователей во главе с Бев Дэвидсон в Айове ввела молекулы RNAi в мозг мышей с БГ и добилась 85-процентного снижения количества сообщения хантингтина. Моторная функция и клеточные аномалии мышей также улучшились. С тех пор несколько различных групп исследователей сообщили об успехе в снижении выработки хантингтина с использованием различных молекул, включая препараты RNAi и ASO. Самые последние работы показывают, что преимущества даже коротких инфузий сохраняются в течение довольно длительного периода.
Задача четвертая: выбор правильной цели
Исследователи лекарств любят выявлять проблемы заранее, а не ждать, пока они произойдут, и одной из возможных проблем с генным глушением является его воздействие на естественную или дикую копию гена хантингтина.
Мы знаем, что полное отсутствие хантингтина опасно. Мыши без какой-либо копии гена умирают до рождения. Поэтому ключевой вопрос заключается в том, вызывает ли снижение количества мутантного хантингтина, необходимого для лечения заболевания, снижение количества хантингтина дикого типа, которое опасно?
На данный момент мы не знаем. Некоторые исследователи считают, что небольшого снижения количества мутантного хантингтина будет достаточно, чтобы дать клеткам шанс на восстановление, поэтому нам не нужно беспокоиться о вредных последствиях незначительного снижения количества белка дикого типа. Другие считают, что нам необходимо разработать методы лечения, которые будут выключать только мутантный белок. Это называется аллель-специфическим глушением — аллелем мы называем каждую из двух копий гена.
Аллель-специфическое глушение звучит очень разумно — если мы можем нацелиться на мутантный ген, почему бы нам этого не сделать? Недостатком является то, что для нацеливания только на одну копию гена необходимо искать в ДНК каждого пациента индивидуальные «орфографические» различия между двумя аллелями. К счастью, такие различия встречаются часто, но нам, вероятно, все равно потребуется несколько различных препаратов, чтобы иметь возможность обеспечить целенаправленное лечение как можно большему количеству пациентов. У некоторых пациентов нет подходящих орфографических различий, на которые можно было бы нацелиться таким образом.
Дебаты о том, необходимо ли аллель-специфическое глушение, продолжаются, но хорошая новость заключается в том, что нам не придется долго ждать ответа, потому что обе методики в настоящее время тестируются разными группами исследователей.
Задача пятая: побочные эффекты
Лечение генным глушением все равно может иметь побочные эффекты, даже если можно избежать возможных проблем со снижением количества хантингтина дикого типа.
Одной из проблем являются так называемые «внецелевые эффекты», когда молекула лекарства прилипает к молекулам-сообщениям для генов, отличных от хантингтина, и мешает им. Это может вызвать любое количество проблем.
Другая проблема заключается в том, что иммунная система мозга может в конечном итоге бороться с «чужеродными» молекулами, которые в него закачиваются, и это может ухудшить ситуацию.
Нам необходимо серьезно отнестись к этим возможным побочным эффектам сейчас, пока мы все еще находимся на стадии тестирования их на животных. Даже довольно мягкие нежелательные эффекты могут быть плохой новостью, особенно если генное глушение в конечном итоге будет использоваться в течение многих лет для предотвращения симптомов у людей, получивших положительный результат теста.
Ученые работают над созданием лучших молекул с наименьшим риском серьезных побочных эффектов, и только самые безопасные будут предложены для испытаний на людях.
Когда, когда, когда?
Волнение по поводу генного глушения оправдано, потому что многие исследователи считают, что это наш лучший шанс на разработку успешных методов лечения БГ. Очевидно, что есть много вопросов, которые необходимо решить, но с каждым годом достигается прогресс, и все согласны с тем, что до сих пор не было обнаружено ничего, что указывало бы на то, что эта методика не будет работать на пациентах.
Прямо сейчас проводятся испытания генного глушения ASO у пациентов с БАС (болезнью двигательных нейронов). Это действительно важно, потому что тестируется не только лекарство, но и система доставки насос-трубка для доставки лекарства туда, где оно необходимо. Тем временем многие исследователи по всему миру выясняют, какие молекулы лучше всего тестировать на пациентах с БГ.
Мы не можем сказать наверняка, когда лечение генным глушением станет доступно для пациентов, но HDBuzz будет разочарован, если мы не увидим испытания генного глушения БГ на людях в самом ближайшем будущем.