
Перенаправление белка хантингтина внутри клеток
Канадская команда расшифровала метки, которые перенаправляют белок хантингтина внутри клеток, помогая объяснить, как он становится токсичным

Внимание: Автоматический перевод — возможность ошибок
Чтобы как можно быстрее распространить новости об исследованиях и испытаниях HD среди как можно большего числа людей, эта статья была автоматически переведена искусственным интеллектом и еще не была проверена редактором-человеком. Хотя мы стараемся предоставлять точную и доступную информацию, переводы ИИ могут содержать грамматические ошибки, неправильные толкования или неясные формулировки.Для получения наиболее достоверной информации, пожалуйста, обратитесь к оригинальной английской версии или вернитесь позже, чтобы получить полностью отредактированный человеком перевод. Если Вы заметили существенные проблемы или если Вы являетесь носителем этого языка и хотели бы помочь в улучшении точности перевода, пожалуйста, обращайтесь по адресу editors@hdbuzz.net.
Мутантный белок хантингтин вызывает болезнь Хантингтона, но не весь мутантный хантингтин одинаково токсичен. Точное место его нахождения внутри клеток оказывает существенное влияние на то, могут ли клетки справиться с мутантным белком. Новые исследования помогают понять сигналы, которые перемещают мутантный хантингтин по клетке, и дают подсказки о том, как сделать его менее токсичным.
Хантингтин — и его злой близнец
Хотя болезнь Хантингтона вызвана генетической аномалией, мы знаем, что повреждение клеток вызвано мутантным белком хантингтином. Ген HD — это набор инструкций для производства белка хантингтина. У людей с HD и тех, кому суждено заболеть, «орфографическая ошибка» в начале генетических инструкций приводит к тому, что определенный участок белка становится длиннее, чем обычно. Слишком много строительных блоков, называемых «глутамин», слипаются вместе на одном конце белка.

Слишком большое количество глутаминовых блоков в начале белка имеет катастрофические последствия и является причиной вредного воздействия мутантного хантингтина.
Одна из основных задач исследователей болезни Хантингтона — выяснить, чем именно мутантный белок отличается от нормального и как эти различия приводят к повреждению клеток. Каждая новая информация о том, как белок вызывает повреждение, является возможной отправной точкой в поиске методов лечения, замедляющих развитие заболевания.
Рэй Труант — исследователь болезни Хантингтона в Университете Макмастера в Онтарио, Канада. Труант и его команда ученых много лет изучают белок хантингтин и поделились многими важными сведениями о том, как он работает и как он выходит из строя при болезни Хантингтона.
N-концевой фрагмент
Хантингтин — большой белок, поэтому изучать его целиком сложно. После открытия гена в 1993 году вскоре было обнаружено, что наиболее вредная часть мутантного белка находится в самом начале. Ученые называют эту часть хантингтина, содержащую дополнительные глутамины, «N-концевым фрагментом».
Помимо критической области, которая мутирует при HD, этот N-концевой фрагмент белка хантингтина имеет ряд других интересных особенностей. Ученые изучают его почти 20 лет и до сих пор обнаруживают ряд неожиданных свойств этого короткого участка белка — свойств, которые оказывают большое влияние на клетки.
Обработка багажа в клетках
Лаборатория Труанта уже обнаружила, что первые семнадцать аминокислотных строительных блоков хантингтина, по-видимому, особенно важны. Они ведут себя как «адресная метка» для всего белка.
В зависимости от того, что происходит с клеткой, небольшие химические «метки» могут прикрепляться к первым семнадцати аминокислотам или удаляться. Транспортный механизм клетки может затем считывать эти метки как штрих-код. В зависимости от имеющегося набора меток белок хантингтин перемещается в разные места в клетке. Таким образом, несмотря на то, что эти семнадцать аминокислот составляют лишь крошечную часть всего белка хантингтина, они могут оказать огромное влияние на местоположение и функцию белка.
Добавление и удаление этих маленьких меток называется «посттрансляционной модификацией». «Трансляция» — это процесс построения белков с использованием инструкций ДНК в наших генах, поэтому «посттрансляционный» просто означает «после того, как белок был построен».
Магические числа: тринадцать и шестнадцать
«Определенные метки на тринадцатой и шестнадцатой аминокислотах хантингтина помогают определить, попадет ли он в ядро».
Понимание посттрансляционной модификации действительно важно при HD, поскольку она, по-видимому, влияет на то, насколько вреден белок. Например, в 2009 году группа Уильяма Янга из Калифорнийского университета в Лос-Анджелесе обнаружила, что добавление двух из этих меток предотвращает появление симптомов у модельных мышей с HD. Эти метки были прикреплены к тринадцатому и шестнадцатому аминокислотным строительным блокам белка хантингтина.
Поскольку эти две химические метки кажутся решающими для того, насколько токсичен мутантный белок хантингтин, важно понять их более подробно. Команда Труанта решила выяснить влияние этих двух меток на то, где в конечном итоге окажется белок и какой вред он причинит, когда окажется там.
Что они выяснили?
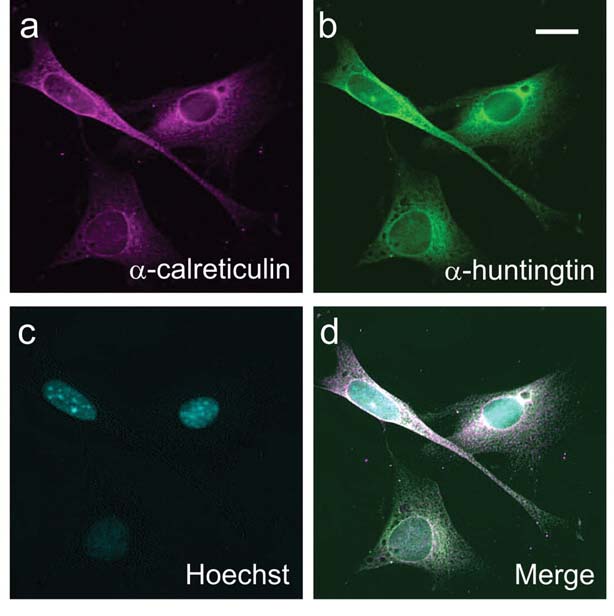
Во-первых, исследователи изучили белок в живых клетках, растущих в чашке в лаборатории. Они генетически изменили клетки так, что они производили только первые семнадцать аминокислотных блоков белка хантингтина, которые они назвали N17. Фрагмент хантингтина N17 был присоединен к белку медузы, который светится желтым цветом. Это позволяет наблюдать за фрагментом N17, когда он перемещается внутри клеток.
Команда Труанта обнаружила, что, когда короткий фрагмент хантингтина был помечен в критических тринадцатом и шестнадцатом местах, он с гораздо большей вероятностью оказывался в ядре клеток.
Ядро — очень важная часть клетки — это место, где хранится, копируется и считывается ДНК. Многие исследователи предположили, что хантингтин более токсичен для клеток, когда он попадает в ядро. Но он также может нанести вред, когда находится за пределами ядра, поэтому важно выяснить, где он наиболее опасен.
Команда пошла дальше, показав, что хантингтин находится в очень специфических местах внутри ядра. Они также разработали новые методы для изучения только помеченных версий белка, а не всех непомеченных копий, плавающих вокруг. Эти инструменты будут очень полезны для будущих исследований, изучающих роль этого процесса маркировки в HD.
Что насчет лекарств?
Эта работа показывает, что определенные метки на тринадцатой и шестнадцатой аминокислотах хантингтина помогают определить, попадет ли он в ядро. Это приводит к идее, что лекарства, которые изменяют маркировку этих аминокислот, могут уменьшить повреждение клеток.
Как бы действовал такой препарат? Или, говоря языком охотников за наркотиками, какова была бы его «цель»?
Что ж, химические метки прикрепляются к хантингтину белковыми машинами, называемыми «киназами». А удаляются они другими машинами, называемыми «фосфатазами». Киназы немного похожи на степлеры, а фосфатазы — больше на устройства для удаления скоб.
Согласно работе Труанта, препараты, снижающие активность киназы «степлера», должны уменьшить количество меток на хантингтине, не допуская его попадания в ядро. Следующим шагом будет выяснение того, где в конечном итоге окажется белок и сделает ли это его более или менее токсичным.
Чтобы проверить этот подход, команда Труанта использовала множество различных препаратов, которые, как известно, воздействуют на киназы. Эти химические вещества, «ингибиторы киназ», могут помочь ученым выяснить, какая конкретная киназа может помечать их любимый белок. Блокируя определенную киназу, а затем используя новые инструменты, которые они разработали для поиска помеченного хантингтина, исследователи могут обнаружить, какие киназы выполняют маркировку.
После тестирования препаратов, блокирующих восемьдесят различных киназ, команда обнаружила, что особую важность имеет определенная киназа, называемая «казеинкиназа 2» — или «CK2». Как и ожидалось, препараты, блокирующие CK2, приводили к тому, что хантингтин становился гораздо менее помеченным в критических местах. Они оказывали эффект удержания хантингтина вне ядра, вместо этого направляя его в часть клетки, «белковую фабрику», эндоплазматический ретикулум или «ER». В процессе этого вред, наносимый клеткам белком, увеличивался.
Подождите, они сделали белок БОЛЕЕ токсичным?!
Конечно, препарат, который делает хантингтин более токсичным, — это прямо противоположное тому, чего мы хотели бы достичь у людей. Так что не спешите в аптеку и не просите бутылку ингибитора CK2.
Если эта работа приведет к разработке методов лечения для пациентов с болезнью Хантингтона, нам понадобится больше помеченного хантингтина, а не меньше. Однако на этом раннем этапе команда Труанта просто пыталась выяснить, какая киназа является наиболее мощной целью.
Ухудшая состояние клеток с помощью препаратов, блокирующих CK2, они смогли подтвердить, что CK2 важна в процессе маркировки, который нас интересует. Будущая работа теперь может быть направлена на понимание того, как добиться обратного эффекта и сделать хантингтин менее токсичным.
Эта работа, проведенная на клетках в чашке, еще далека от создания методов лечения, которые можно использовать на пациентах. Но это важный шаг вперед, который помогает нам понять одного из ключевых игроков в повреждении клеток при болезни Хантингтона и открывает новую дверь для исследователей, работающих над будущими методами лечения.
Эта статья была обновлена 27 июня, чтобы уточнить эффект маркировки и препаратов, блокирующих CK2.


