Конференция по терапии болезни Хантингтона 2018 — день 3
Новости с 3-го дня конференции по терапии болезни Хантингтона: белок хантингтин — и его снижение

Доброе утро с заключительного дня конференции по терапии БГ 2018 года! Сегодня две сессии, первая посвящена белку, вырабатываемому геном БГ. Вторая включает в себя новости об исследованиях по снижению уровня хантингтина от Wave Life Sciences и Ionis Pharmaceuticals.
Утро четверга — белок хантингтин
Каждый пациент с БГ унаследовал одну и ту же мутацию — удлинение последовательности C-A-G. Это расширение происходит в гене, который мы теперь называем геном БГ. Гены используются клетками в качестве инструкций для производства белков — первая сегодняшняя сессия посвящена белку БГ.

Сандрин Юмбер, Университет Гренобль-Альпы, давно интересуется развитием мозга и тем, как ген и белок БГ влияют на этот процесс. Чтобы понять этот процесс, лаборатория Юмбер создала мышь, у которой в мозге отсутствовал ген и белок БГ. Они обнаружили, что клетки, лишенные гена БГ, делились и двигались ненормальным образом. Во время развития мозга новорожденные клетки ползут к своему правильному местоположению, часто взбираясь по «канатам», образованным другими клетками. Этот процесс изменяется при удалении гена БГ, что указывает на важную роль гена БГ в этом процессе.
Андреа Карикасоле, научный парк IRBM, проводит масштабное исследование «посттрансляционных модификаций» белка хантингтина. Это относится к крошечным химическим «украшениям» белка хантингтина. Эти украшения позволяют клеткам настраивать функцию белков. Белок хантингтина, например, имеет, вероятно, десятки этих меток, которые добавляются и удаляются, настраивая функцию хантингтина в ответ на широкий спектр сигналов. Многие из этих украшений делают интригующие вещи с белком хантингтина и могут даже предотвратить повреждение клеток мутантным белком хантингтина. Мы уже писали об этом на HDBuzz. Команда Карикасоле разрабатывает очень чувствительные тесты для отдельных украшений белка хантингтина. Они позволяют им отслеживать, какие из них изменяются в ходе заболевания, и, возможно, искать способы их исправления.
Рохит Паппу, Вашингтонский университет, применяет очень целенаправленный подход к пониманию белка хантингтина. Его лаборатория разрабатывает инструменты для изучения той части белка, на форму которой влияет мутация БГ. Лаборатория Паппу использует огромные вычислительные мощности, чтобы попытаться предсказать форму части белка хантингтина, измененной мутацией. Эти методы позволяют им наблюдать форму «головастика». Форма этого головастика была предметом интенсивных дебатов в области БГ! Методы Паппу решительно поддерживают одну сторону этих дебатов, что, несомненно, поможет нам лучше понять эту критическую часть белка хантингтина.
Сяо-Цзян Ли из Университета Эмори разработал интересную модель на мышах, в которой ген хантингтина можно выключать у взрослых мышей, в мозге, теле или и там, и там. У этих мышей нет расширенных генов хантингтина — они просто помогают нам понять, имеет ли выключение «здоровой» версии гена какие-либо последствия. К счастью, когда ген выключается, в мозге ничего плохого не происходит. Неожиданно выключение гена вызвало воспаление поджелудочной железы. Неясно, что это может означать для пациентов, но текущие методы лечения, снижающие уровень хантингтина, не должны значительно снижать уровень хантингтина в организме — только в мозге. Ли также использовал редактирование генома CRISPR-Cas9, чтобы вырезать вредную часть гена БГ у мышей. Деактивация мутантного гена у мышей успешно снизила образование токсичного белка хантингтина, и мыши стали лучше двигаться. Доктор Ли был очень занят! Он также создал модель болезни Хантингтона на свиньях с использованием редактирования генома CRISPR. Это может быть полезно для тестирования новых лекарств, поскольку мозг свиньи похож на человеческий.
«Коханек заморозил белок и использовал электронный луч, чтобы сделать тысячи его фотографий. Затем они были объединены компьютером для получения первых в истории изображений подробной молекулярной структуры белка хантингтина».
Анкур Джайн из @UCSanDiego изучает РНК — «молекулы-мессенджеры», образующиеся, когда клетка хочет использовать инструкции в ДНК для производства белка. Наша ДНК находится в ядре наших клеток, но РНК свободно плавает по всей клетке. Традиционный способ мышления о многих генетических заболеваниях мозга заключается в том, что они вызваны токсичными белками, но появляется все больше свидетельств того, что иногда молекулы-мессенджеры РНК, производимые из мутантных генов, также могут быть токсичными. Например, некоторые последовательности РНК могут прилипать к важным белковым машинам и мешать им выполнять свою работу в клетке. Одним из возможных признаков токсичной РНК является образование аномальных сгустков РНК, наблюдаемых в клетках при БГ и других заболеваниях мозга. Джайн обнаружил, что он может образовывать искусственные сгустки РНК, нагревая и охлаждая ее, как желе. Эти сгустки образуются только тогда, когда РНК содержит липкие последовательности, такие как последовательность из участка CAG при БГ. Неясно, вызывают ли эти сгустки РНК вред при БГ, но они могут. Например, если РНК застряла в ядре, ее нельзя использовать для производства белков. Антисмысловые молекулы (аналогичные тем, которые в настоящее время проходят испытания на людях с БГ) могут прилипать к РНК в ядре и предотвращать образование сгустков. Другие лекарства теоретически можно использовать для решения проблемы липкости РНК при заболеваниях мозга.
Захватывающий поздний доклад Стефана Коханека, чья лаборатория только что раскрыла структуру белка хантингтина! Выяснение того, как выглядят белки, является действительно важным шагом в понимании того, как они работают и как это изменить с помощью лекарств. Ген хантингтина был открыт 25 лет назад, но белок большой, шаткий и липкий, что очень затрудняет определение его структуры. Одна команда даже отправила белок в космос, чтобы попытаться сформировать кристаллы, но, увы, безуспешно. Команда Коханека добилась успеха там, где другие потерпели неудачу, и их результаты только что были опубликованы в Nature. Большим прорывом стала стабилизация хантингтина с помощью другого белка, называемого HAP40 («хантингтин-ассоциированный белок 40»). После стабилизации с помощью HAP40 Коханек заморозил белок и использовал электронный луч, чтобы сделать тысячи его фотографий. Затем они были объединены компьютером для получения первых в истории изображений подробной молекулярной структуры белка хантингтина. Это очень круто и дает нам массу материала для работы. Однако есть одна оговорка: некоторые области все еще были слишком шаткими, чтобы определить структуру, включая самую важную часть в начале белка, которая содержит мутацию.
Вторая половина дня четверга — снижение уровня хантингтина
Большое завершение дня и конференции, поскольку начинается сессия по терапии снижения уровня хантингтина. Снижение уровня хантингтина относится к подходам, направленным на снижение уровня белка хантингтина. Существует множество способов сделать это, но многие из них нацелены на «РНК», которая является промежуточным звеном между информацией в гене БГ и белком хантингтина.
Майкл Рейп, Калифорнийский университет в Беркли, заинтересован в том, чтобы обманом заставить клетки разрушать отдельные белки в клетке. Во многих случаях, включая БГ, было бы действительно полезно избирательно удалять один конкретный белок. У клеток есть более одного пути деградации белка — важный использует крошечное химическое украшение, называемое «убиквитин», в качестве метки. Клетки распознают убиквитин как своего рода сигнал «съешь меня» и разрушают белки, несущие их. Лаборатория Рейпа участвовала в понимании того, как клетки используют метки убиквитина для маркировки белков, которые необходимо очень быстро разрушить — например, тех, которые могут быть токсичными. Лаборатория Рейпа создала инструменты, которые позволяют исследователям впервые наблюдать, как белки проходят через этот путь быстрого разрушения. Механизм быстрого разрушения белка является мощным инструментом — лаборатория Рейпа заинтересована в его использовании. Недавно разработанный метод — под названием «PROTAC» — позволяет исследователям использовать систему убиквитина, чтобы заставить клетки разрушать определенные белки.
Скотт Цейтлин (Университет Вирджинии) работает с мышами с БГ, чтобы попытаться выяснить, что происходит, когда мы снижаем уровень мутантного хантингтина, нормального хантингтина или обоих. Имейте в виду, что каждый человек наследует один хантингтин от каждого родителя — и у большинства людей с БГ есть одна нормальная и одна мутантная копия. Ученые называют здоровый/нормальный белок «диким типом», потому что он более распространен в дикой природе. Эти вопросы важны, потому что все методы лечения, снижающие уровень хантингтина, направлены на уменьшение общего количества белка хантингтина в мозге. Некоторые, как препарат Ionis, снижают обе версии белка в равной степени. Другие, как препараты Wave, стремятся снизить уровень мутантного белка больше, чем белка дикого типа. Мы считаем, что снижение уровня мутантного белка само по себе или параллельно с белком дикого типа будет полезным, но остается открытым вопросом, безопасно ли снижение уровня хантингтина. Цейтлин вывел мышей, у которых производство мутантного белка, белка дикого типа или обоих белков можно снизить после того, как мышь полностью вырастет. Цейтлин обнаружил, что снижение уровня мутантного хантингтина на ранней стадии оказывает большее влияние с точки зрения накопления белка в мозге. Аналогичным образом, раннее снижение уровня мутантного хантингтина оказало большее влияние на потерю веса и двигательные навыки у мышей. То же самое было верно и для снижения производства обеих версий белка — раннее лечение приносило больше пользы. Суть: чем раньше, тем лучше, когда дело доходит до подавления хантингтина. В одном тесте (сила хвата) снижение только мутантного белка улучшило результаты, но подавление обеих версий — нет. В противном случае оба подхода были примерно одинаково эффективны, и ключевым фактором было то, как рано было проведено лечение. Цейтлин также посмотрел, что происходит, если вы позволите хантингтину восстановиться, и это было плохо для мышей. Это говорит о том, что долгосрочное лечение лучше, чем краткосрочное — именно то, что вы ожидаете.
Джоди Макбрайд, OHSU, описывает свою работу с использованием безвредных вирусов для доставки инструкций клеткам мозга, которые помогают им создавать собственные молекулы, разрушающие РНК. Одним из преимуществ такого подхода является то, что вирусы позволяют молекулам, разрушающим РНК, создаваться навсегда, что теоретически позволяет проводить однократное лечение. Макбрайд изучает свое лечение, доставляя его обезьянам, у которых большой сложный мозг, который гораздо больше похож на наш. В частности, ее команда работает над доставкой вируса в часть мозга, называемую «скорлупа». Скорлупа особенно интересна, потому что это одна из самых уязвимых областей мозга при БГ — она сильно сокращается у людей, которые наследуют мутацию БГ. Макбрайд описывает улучшения в хирургии головного мозга, необходимой для доставки вирусов, включая использование МРТ для визуализации мозга во время инъекций. Вирусное лечение привело к снижению РНК гена БГ примерно наполовину по всей скорлупе, что является заметным улучшением по сравнению с предыдущими попытками. Далее — Майк Панзара из Wave Life Sciences, который планирует 2 испытания с использованием «антисмысловых олигонуклеотидов» (АСО) для БГ. АСО — это короткие модифицированные фрагменты ДНК, которые проникают в клетки и разрушают целевую РНК, снижая уровень целевого белка.
Панзара сообщает толпе, что Wave в настоящее время проводит два испытания АСО на пациентах с БГ. Почему два? Подход Wave основан на нацеливании на крошечные генетические вариации — называемые SNP или «снипы» — в гене БГ. Эти крошечные вариации не вызывают БГ, они просто являются частью нормальной генетической вариации между людьми — причина, по которой мы не все идентичные близнецы. Интересно, что эти варианты встречаются только на одной из 2 копий гена БГ, которые есть у каждого человека. Нацеливаясь на эти варианты, АСО Wave могут различать мутантные и немутантные копии гена БГ. Wave в настоящее время проводит ранние исследования безопасности 2 АСО в исследованиях под названием PRECISION-HD1 и PRECISION-HD2. АСО, используемые в этих исследованиях, нацелены на различные генетические вариации в гене БГ. Хитрость этого подхода заключается в том, что люди должны не только унаследовать мутацию БГ, но и сопутствующие варианты, которые позволяют уникально нацеливаться на мутантную копию гена. Таким образом, эти испытания обязательно сосредоточены на пациентах, несущих эти вариации. Wave разработала действительно крутые новые технологии для обнаружения этих вариантов и определения того, какие из них находятся на мутантной копии гена БГ, а не на нормальной копии. Wave провела предварительное исследование, в котором они смогли найти цели для своих АСО у 64% добровольцев.
«Спонтанные аплодисменты, когда Табризи благодарит храбрых добровольцев в первом исследовании, называя их «настоящими героями исследований».»
Далее Энн Смит из Ionis и Сара Табризи из UCL представляют результаты испытания, разработанного для тестирования АСО, нацеленных на обе копии гена БГ. Это кульминация многолетней работы — Смит напоминает аудитории, что программа Ionis началась в 2005 году! Они начали с исследований на клетках и животных, которые предоставили ранние доказательства того, что лечение АСО снижает уровень белка хантингтина и улучшает симптомы, подобные БГ. В 2012 и 2013 годах были опубликованы результаты исследований на мышиной модели БГ, которые показали, что снижение уровня хантингтина улучшает симптомы, подобные БГ. Смит излагает логику, которую @ionispharma использовала для принятия решения об использовании АСО, нацеленных на обе копии гена БГ, а не только на мутантную копию. Одним из преимуществ АСО является то, что они широко распространяются по всему мозгу. Смит показывает данные экспериментов на обезьянах, демонстрирующие, что после инъекции в спинномозговую жидкость АСО очень широко распространяются по всему мозгу. Ionis также изучила распространение даже более крупных животных, таких как свиньи, обнаружив, что препарат распространяется очень широко. Затем были проведены исследования токсичности, которые показали, что длительное введение препарата очень хорошо переносится (до 15 месяцев в исследованиях на обезьянах). Практически невозможно взять образцы ткани мозга у пациентов, получавших АСО, — так как мы узнаем, выполнил ли АСО свою работу? Смит описывает исследования на обезьянах, устанавливающие связь между снижением уровня хантингтина в мозге и снижением уровня спинномозговой жидкости. Это позволило Ionis создать очень сложную компьютерную программу для прогнозирования того, насколько снижается уровень хантингтина в мозге и спинномозговой жидкости, которая легко доступна с помощью люмбальной пункции. В этот момент к Ionis присоединился крупный фармацевтический партнер, Roche, у которого есть ресурсы и опыт для проведения сложных испытаний АСО на людях.
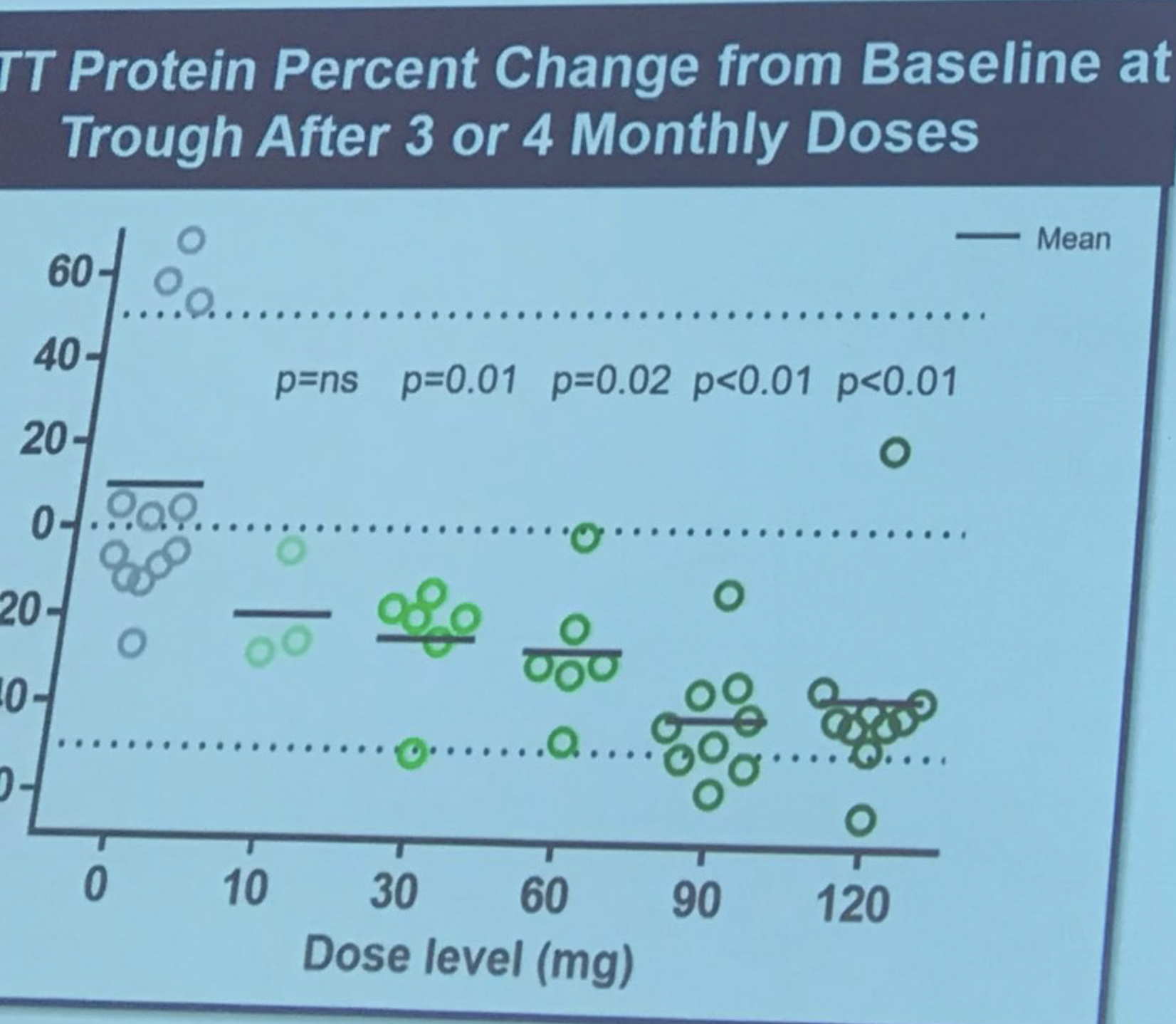
Сара Табризи выходит на сцену, чтобы описать первое испытание на людях лечения АСО Iois/Roche. Это исследование было исследованием «безопасности» — основной причиной проведения исследования было установление безопасности препарата. Исследование проводилось в 9 центрах в Великобритании, Германии и Канаде. АСО доставлялись пациентам путем инфузии в спинномозговую жидкость в «эскалационной дозе», что означает, что ранние субъекты получали низкую дозу, а более поздние субъекты — более высокую. Это тщательное наращивание дозы проводится для того, чтобы врачи, независимые от исследования, могли проводить оценку безопасности. В этом исследовании приняли участие 46 невероятно храбрых добровольцев, которые были готовы пойти на определенный риск, будучи первыми людьми, подвергшимися воздействию препарата. Исследователи смогли измерить уровень белка хантингтина в спинномозговой жидкости, который, как они ранее показали, очень хорошо коррелирует с уровнями в мозге (которые, помните, мы не можем измерить напрямую).
Размер сокращения действительно поражает — в среднем до 40–50%! Табризи описывает чувства исследователей, что снижение уровня хантингтина может продолжать улучшаться в течение 6 месяцев. И вот, по прогнозам Табризи, насколько это соответствует снижению уровня белка в мозге. Компания Ionis разработала своего рода модель, которая позволяет им делать прогнозы о взаимосвязи между снижением уровня хантингтина в спинномозговой жидкости и в тканях мозга. Это говорит о том, что снижение уровня хантингтина в ткани мозга может быть довольно высоким. Пациенты очень тщательно наблюдались на предмет безопасности, серьезных побочных эффектов не выявлено. Табризи: «Препарат был безопасным и хорошо переносился во всех протестированных дозах». Успех! Все участники исследования сейчас находятся на так называемом «открытом расширении» — те, кто принимал плацебо, были переведены на препарат, и за ними продолжат наблюдение. Спонтанные аплодисменты, когда Табризи благодарит храбрых добровольцев в первом исследовании, называя их «настоящими героями исследований».
Какой прекрасный способ завершить встречу — впереди невероятно захватывающие времена, поскольку Roche и Ionis планируют следующее испытание, которое будет разработано для определения того, улучшает ли препарат симптомы БГ у большего числа людей.
Обновление: Заявление сообщества Ionis об итогах.