Двойной успех в подавлении экспрессии гена гентингтина при помощи РНК-интерференции
2 хорошие новости по РНК-интерференции при БГ: безопасность и возможность воздействовать на большие участки мозга.
 Публикация Professor Ed Wild 24 февраля 2012 Перевод Dr Yury Seliverstov Под редакцией Dr Jeff Carroll Первоначально опубликовано 24 января 2012
Публикация Professor Ed Wild 24 февраля 2012 Перевод Dr Yury Seliverstov Под редакцией Dr Jeff Carroll Первоначально опубликовано 24 января 2012
Большинство исследователей БГ возлагают большие надежды на концепцию “выключения” гена болезни Гентингтона с целью уменьшения образования патологического белка гентингтина. Благодаря совместной работе учёных из университетов и биотехнологических компаний разрешение двух крупных проблем - безопасности и доставки препарата - уже очень близко.
Мы являемся большими поклонниками концепции подавления экспрессии генов. Как и многие исследователи БГ, мы считаем такой подход наиболее перспективным в разработке лечения этого заболевания.
Подавление экспрессии гена вызывается специально созданным препаратом, блокирующим информационную молекулу, называемую РНК, которая образуется с гена БГ и даёт команду клетке синтезировать патологический белок гентингтин. Использование препарата приводит к уменьшению образования клеткой этого белка.
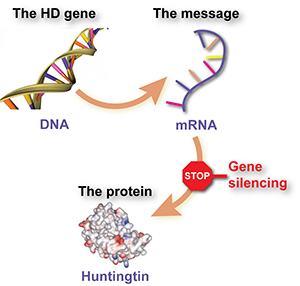
Говоря проще, подавление гена - это своего рода “стоп-сигнал” для мутантного гентингтина.
Быстрый научный прогресс
На сегодняшний день подавление экспрессии гена БГ в различных своих вариантах не представляет каких-либо трудностей. Эта методика была протестирована на нескольких моделях БГ на мышах и крысах, и её использование приводило не только к замедлению прогрессирования болезни, но и к уменьшению выраженности симптомов и степени повреждения головного мозга. Похоже, что мозг, действительно, может до определённой степени восстанавливаться при возможности снижения уровня патологического белка.
Остающиеся проблемы
Несколько исследовательских групп работают над организацией клинических испытаний препаратов, подавляющих экспрессию гена БГ. Однако остаются некоторые вопросы, которые необходимо решить, прежде чем эти испытания начнутся.
Во-первых, это безопасность. Всегда возможно развитие непредвиденных побочных эффектов, которые могут быть достаточно серьёзными, учитывая, что препарат будет вводиться непосредственно в нервную систему и вмешиваться в работу клеток на генетическом уровне.
Во-вторых, это метод доставки лекарственного препарата. Подавляющие экспрессию генов препараты не могут приниматься как таблетки или вводиться в виде инъекций, поскольку таким образом они не смогут проникнуть в головной мозг. Поэтому они должны вводиться непосредственно в нервную систему. В зависимости от структуры препарата это означает проведение операции по введению специальных игл или трубочек либо в позвоночник, либо в череп. Это может показаться слишком радикальным способом, однако, при эффективности терапии это будет вполне оправданно.
Но на этом проблема доставки препарата не заканчивается, так как, попав в голову, ему необходимо проникнуть внутрь клеток головного мозга, чтобы оказать своё действие.
Выбор препаратов, подавляющих экспрессию гена
Исследователи должны остановить свой выбор не нескольких препаратах, которые затем будут включаться в клинические испытания. Для того, чтобы Вам было проще воспринимать будущие статьи, мы немного поясним этот аспект.
Во-первых, мы должны определиться с химической структурой используемого вещества. Принципиально рассматриваются либо препараты интерферирующих РНК (иРНК), которые сходны по своей структуре с молекулами матричных РНК, либо препараты, содержащие антисмысловые олигонуклеотиды (АСО), которые несколько отличаются по химической структуре, однако, могут лучше усваиваться клетками.
Во-вторых, необходимо определиться с целью, на которую будет воздействовать препарат: будут ли это обе копии гена БГ или только мутантный аллель. Воздействие на обе копии называется неспецифическим подавлением экспрессии - это проще в осуществлении, однако, выключение и “нормального” гена может быть опасным. Выключение только мутантного гена называется аллель-специфическим подавлением экспрессии и является более сложным с технической точки зрения, но в то же время более безопасным.
В-третьих, распространение - как будет распределяться лекарственное вещество? На самом деле, препараты интерферирующих РНК не распространяются на большие расстояния, поэтому лекарственное вещество должно быть введено непосредственно в вещество головного мозга. Препараты, распространяющиеся на более большие расстояния, как АСО, могут вводиться в цереброспинальную жидкость вокруг мозга или, при хорошем стечении обстоятельств, в основание позвоночного столба (эндолюмбально).
В-четвёртых, необходимо выбрать способ доставки. Будет ли вводиться средство само по себе, в составе вирусных частиц или подаваться под определённым давлением через помпу с целью увеличения площади распределения.
Наконец, в-пятых, важно определить режим введения препарата. Необходимо ли введение лекарственного вещества однократно или в течение недель или месяцев. На сегодняшний день мы не можем сказать, как долго продлится лечебный эффект, поэтому этот вопрос должен быть решён путём сравнения различных режимов введения препарата.
Какую бы статью по исследованию подавления экспрессии генов Вы ни читали, в первую очередь при её прочтении необходимо ответить для себя на каждый из этих вопросов.
Мнения трёх разных сторон совпали
На недавнем Мировом конгрессе по БГ в Мельбурне, как уже сообщалось на HDBuzz, несколькими исследовательскими группами, занимающимися проблемой подавления экспрессии генов, было представлено три интереснейших доклада. Затем в ноябре мы опубликовали новости о первом испытании на безопасность препаратов, подавляющих ген гентингтина с использованием РНК-интерференции, на мозге приматов.
«иРНК-препараты проникли глубже, чем при обыкновенном введении. Гораздо глубже. »
В настоящее время опубликовано ещё две научные статьи, каждая из которых является плодом сотрудничества между университетскими учёными и исследователями биотехнологических компаний. Обе статьи были написаны с участием компании Medtronic, штаб-квартира которой располагается в Миннеаполисе, и группы под руководством доктора Дземин Дзяна (Dr Zheming Zhang) из Университета Кентукки.
Безопасное применение в течение шести месяцев
Ноябрьское сообщение о безопасности применения препаратов интерферирующих РНК у приматов касалось короткого шестинедельного исследования. Новое исследование компании Medtronic и группы доктора Дзяна, опубликованное в журнале Brain, было так же проведено на макаках-резус, но длилось при этом шесть месяцев.
Давайте охарактеризуем проведённое исследование по описанным выше пунктам.
Структура препарата: это было испытание препарата интерферирующих РНК.
Мишень: воздействовали на обе копии гена, таким образом, это было неспецифическое выключение гена.
Распределение: препарат вводился в стриатум (полосатое тело) - область головного мозга, поражающаяся раньше всего у пациентов с БГ.
Доставка: препарат был упакован в пустые частицы аденоассоциированного вируса AAV2.
Режим введения: однократное введение в пять точек каждого полушария головного мозга.
Также необходимо отметить, что в исследовании использовались здоровые обезьяны, без мутаций, приводящих к развитию БГ. Поэтому это исследование позволяет судить только о безопасности и изменении содержания белка гентингтина, но не о возможных улучшениях в состоянии пациентов.
После проведённого лечения за обезьянами наблюдали в течение шести месяцев, контролируя их общее состояние и степень контроля двигательной активности. Операция была хорошо ими перенесена, и никаких проблем с состоянием их здоровья зафиксировано не было.
Как и ожидалось, уровень белка гентингтина значительно снизился в областях, куда вводился препарат. В каждой области введения содержание белка понизилось на участке протяжённостью около 6 миллиметров - по занимаемому объёму это приблизительно равно трём драже M&M’s на каждое полушарие. Возможно, это звучит не очень внушительно, однако, для мозга человека изменения в таких масштабах имеют очень большое значение, и учтите, что эти измерения проводились через 6 месяцев после однократного введения препарата.
К счастью, лекарственное вещество не привело к развитию таких осложнений со стороны головного мозга, как воспалительный процесс, инфекция или повреждение нейронов.
Таким образом, препарат выполнил свою функцию по снижению уровня белка, не вызвав при этом серьёзных побочных эффектов. Авторы подсчитали, что шесть месяцев жизни обезьяны равносильны восемнадцати месяцам жизни человека. Звучит неплохо, однако, по словам учёных, для того, чтобы выявить хорошие или плохие эффекты препарата у людей, может потребоваться гораздо больше времени.
Инновационный метод доставки препарата
Другая новая статья написана совместно исследовательской группой из Университета Кентукки, компанией Medtronic, а также компанией Alnylam Pharmaceuticals, занимающейся разработкой препаратов на основе интерферирующих РНК. Она была опубликована в журнале Experimental Neurology.
Это исследование так же касалось неспецифического подавления экспрессии с использованием иРНК, вводившихся обезьянам в стриатум.
Работу эту отличает инновационный подход к доставке лекарственного препарата. Ими применялся конвекционный метод доставки (КМД). Его использование подразумевает введение специальных трубочек через череп в вещество головного мозга. Верхний конец трубки соединяется с небольшой помпой, благодаря которой препарат непрерывно подаётся под определённым давлением. Подача лекарственного вещества под давлением является ключевым моментом, так как именно благодаря этому молекулы препарата распространяются на большее расстояние, чем обычно.

КМД уже используется для введения химиотерапевтических препаратов при лечении опухолей головного мозга. Но будет ли этот метод работать при использовании препаратов на основе интерферирующих РНК?
Во-первых, препарат вводился в головной мозг при помощи помпы в течение семи дней. Введение производилось только в одно полушарие с целью последующего сравнения с нетронутым полушарием. Пробовались различные дозировки и режимы подачи лекарственного вещества для определения оптимального соотношения. После этого проводилось введение препарата в течение 28 дней. Учёные использовали безвредную модификацию препарата, меченую радиоактивным составом, что позволяло точно отслеживать, насколько глубоко вводимое лекарство распространяется.
Препарат выполнил свою функцию по снижению уровня гентингтина, а введение трубочек и сам процесс подачи лекарства прошли безвредно для головного мозга.
Было ли оправдано использование столь сложной системы для подачи лекарства - достигло ли оно более глубоких отделов мозга? Да.
Измерения показали, что иРНК-препарат проник глубже, чем при обыкновенном введении. Если бы такая подача лекарства осуществлялась в оба полушария мозга, уровень гентингтина понизился бы в суммарном объёме вещества головного мозга, равном объёму одиннадцати драже M&Ms.
Таким образом…
Ещё до публикации этих двух статей мы уже знали о том, что содержание гентингтина в головном мозге обезьян можно снизить при помощи иРНК. Теперь мы можем поставить две крупные галки в списке наших целей: во-первых, подавление экспрессии гена работает и является безопасным при применении в течение длительного времени, а во-вторых, существуют методы более глубокой доставки лекарства в головной мозг.
С какими проблемами мы можем столкнуться?
Однако при всех положительных моментах в данной ситуации следует сохранять сдержанный оптимизм. Безусловно, существует ряд трудностей, с которыми мы может столкнуться при подготовке или проведении клинических испытаний на людях.
Описанные исследования на приматах показали безопасность снижения уровня гентингтина на здоровых обезьянах. Но это не означает, что это будет так же безопасно при использовании данной методики на больных людях. Человеческий мозг гораздо больше и сложнее, нежели мозг обезьяны. Поэтому проводимое лечение может быть менее эффективным или более опасным просто вследствие различий двух биологических видов.
Также вполне возможно, что нормальный белок гентингтин каким-то образом защищает головной мозг человека от действия своего мутантного собрата. В этом случае выключение обеих копий гена может привести скорее к неблагоприятным, нежели хорошим, последствиям.
Вполне возможно, что мозг пациентов с БГ является более чувствительным, и проведение на нём операций будет непростой задачей. При БГ участки головного мозга, подлежащие введению лекарственного вещества, уменьшены в объёме. Это осложняет проведение операции и делает её в некоторой степени более рискованной.
Наконец, отслеживать успешность проведения лечения у людей достаточно затруднительно, так как заболевание прогрессирует медленно и отсутствует возможность оценить состояние нервной ткани микроскопически.
Однако никогда не забывайте - над разрешением этих проблем работают лучшие учёные мира, чтобы эффективное лекарство против БГ стало реальностью.
2012 год - время выключения гена БГ?
Станет ли 2012 год для пациентов началом нового этапа в лечении БГ? Увидим ли мы одно или несколько клинических испытаний методики подавления экспрессии гена на людях в ближайшие месяцы? С нынешним темпом научного прогресса, мы уверены, это вполне возможно, и несколько исследовательских групп активно работают, чтобы претворить это в жизнь. Первые испытания планируются небольшими и будут проводиться с большой осторожностью, ведь главное - не навредить. Но если всё пойдёт хорошо, в дальнейшем будут организованы более крупные клинические исследования.


